技術資料
紫外線励起酸素を用いた滅菌システムにおける酸素注入条件の検討
- Investigation of Generating Active Oxygen From Oxygen Gas in a Sterilization System Employing Ultraviolet Irradiation -
技術本部 研究開発部 光応用研究課
独立行政法人産業技術総合研究所 野田 和俊
東海大学工学部機械工学科 岩森 暁
キーワード
励起酸素,活性酸素種,滅菌処理,バイオロジカルインディケータ,BI,滅菌袋,紫外線ランプ,水晶微小天秤,QCM,指標微生物,枯草菌,芽胞
本記事は,一般社団法人日本真空学会発行誌「Journal of the Vacuum Society of Japan」2012年発行,第55巻第8号389-394頁に掲載された記事を,体裁を変更して掲載するものである。
Abstract
We have been investigating an advanced sterilization system that uses active oxygen species (AOS). We used sterilization equipment that generates AOS from pure oxygen gas by using ultraviolet irradiation and an evacuation system to study the conditions necessary for oxygen injection into the system’s chamber. In this way, we optimized the operating conditions for oxygen regulation. Through scanning electron microscope observations, we characterized the mechanism by which AOS inactivated spore-forming bacteria such as Bacillus subtilis.
1.はじめに
近年,高圧蒸気滅菌(オートクレーブ)に適さないプラスチック製品等の滅菌にはEOG(エチレンオキサイドガス)滅菌器やホルマリン消毒器,また最近では過酸化水素低温プラズマ滅菌器が使用されているが,滅菌工程で使用する薬液の人体への有毒性,残留性,環境に及ぼす影響が懸念され代替技術が切望されている1)-4)。筆者らは,新しい滅菌技術として酸素ガスに紫外線を照射して発生する「励起酸素種」を用いた滅菌技術を検討している5)。
励起酸素(もしくは活性酸素種)は,酸素ガスの放電や放射線反応により得られ,生成種として酸素原子,励起酸素分子,オゾン等であることが知られる6)。生成した励起酸素自体は微生物や人体に有害とされるが,酸素を原料とするので,その扱いは容易であり短時間で有機物と反応して分解,或いは失活してしまうので残留性の心配が無いという特長を有している。本報では紫外線励起方式の酸素滅菌装置を試作し,紫外線で発生させた酸素励起種を減圧システムを使って滅菌対象物中に浸透させる際の酸素注入速度などの処理条件が滅菌工程に及ぼす影響を検討した。
2.実験方法
2.1 紫外線による励起酸素の発生機構
酸素雰囲気下での励起酸素(活性酸素)発生の光化学反応式を下記に示す6)-8)。
- ³O₂+hν(λ<242nm)→O(³P)+O(³P)
- ³O₂+O(³P)→O₃
- O₃+hν(λ<310nm)→O(¹D)+¹O₂
ここで,³O₂は基底状態酸素分子,¹O₂は励起状態酸素分子,O(³P)は基底状態酸素原子,O(¹D)は励起状態酸素原子,O₃はオゾン分子を示す。
酸素分子(³O₂)は,波長242nm以下の紫外域に光の吸収帯を持ち,波長帯によりSchumann-Runge continumn(130~175nm)Schumann-Runge bands(175~200nm)と呼ばれる。酸素分子は,それらの紫外線を吸収することにより2個の基底状態酸素原子(O(³P))に分解される(式(1))。この酸素原子は不安定なため,再び酸素分子と結合してオゾン(O₃)を生成する(式(2))。発生したオゾンは比較的安定な活性種であるが,Hartley bands(220~300nm),Huggins bands(300~375nm),Chappuis bands(450~850nm),Wulf bands(700~1000nm)と紫外から赤外域まで多くの吸収帯を持ち,その中でもHartley bandsは他の吸収帯と比べて最も吸収が大きく,極大付近の254nmの吸光係数は約308cm⁻¹である。オゾンは,この波長帯の紫外線を吸収すると励起状態酸素分子(¹O₂)と励起状態酸素原子(O(¹D))に分解される(式(3))。一般に紫外線光源として利用される低圧水銀ランプでは,石英管内部に数10mgの水銀と数100Paのアルゴンガスが封入され,電極間に電圧を印加するとランプ管内の電離作用により水銀原子が励起される。その水銀原子が基底状態に遷移する際に波長184.9nmの真空紫外線ならびに波長253.7nmや297,302,313,366nmなどの紫外線を放射する9)。このランプの紫外線を酸素に作用させると,Schumann-Runge bandsに属する波長184.9nmの紫外光で³O₂は分解しO(³P)を経てO₃を生じ,O₃はHartley bandsに属する253.7nmの紫外光で分解され,次々に新しい活性酸素種が誕生する。生じた励起状態酸素分子(¹O₂)も励起状態酸素原子(O(¹D))も共に反応性の高い活性種であるので,これらを滅菌対象物に有効に作用させれば強い殺菌効果が期待できる。
2.2 実験装置および操作方法
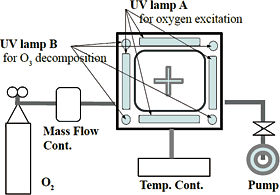
図1 活性酸素種滅菌システム構成模式図
使用した試験装置のシステム構成を図1に示す。試験装置は,試験容器であるチャンバー,電源装置,それに付帯する酸素ボンベ,真空ポンプ,分解触媒,温度コントローラー等で構成される。チャンバーは滅菌対象物を処理するための容器で,実効容積45ℓ(W400×L615×H400),内部に励起酸素を発生させる紫外線ランプ(UV-lamp A,200W低圧水銀ランプQGL200G-3:岩崎電気(株)4灯が上下左右の4面に,またオゾン分解用の紫外線ランプ(UV-lamp B,30W低圧水銀ランプQGL30-2:岩崎電気(株)が四隅に,内部空間を冷却する送風ファン付きのヒートシンクが内背面に配置されている。
ここで励起酸素を発生させる紫外線ランプ(UV-lamp A)とは,低圧水銀ランプの発光波長である波長184.9nmや253.7nmなど全領域の紫外線を放射するランプで,波長184.9nmの放射により基底状態酸素原子やオゾンを発生させると同時に,波長253.7nmによりオゾンを分解して励起酸素原子・分子を大量に発生させる。一方,オゾン分解用の紫外線ランプ(UV-lamp B)とは,波長184.9nmの真空紫外域の発光を発光管でカットして放射を無くした紫外線ランプで,オゾンを発生させず波長253.7nmによりオゾン分解にのみ寄与するランプで,チャンバー内に生じたオゾンを速やかに分解して除去するために使用する。また,チャンバーには酸素を供給するための酸素ボンベが流量調節器を介して接続され,チャンバー内の気体を外部に送り出す真空ポンプがオゾン分解触媒を介して接続されている。その他直接外気を取り込むための弁(コック)が除埃フィルターを介して接続され,チャンバーおよび紫外線ランプを一定の温度に保つための配管および温度コントローラーがチャンバーの下部に接続されている。酸素ボンベは,工業用の乾燥酸素(純度99.9%以上),流量調節器はマスフローコントローラ(MODEL8550MC:KOFLOC),真空ポンプはスクロール真空ポンプ(ポンプ型式FO0009A:日本ブッシュ(株),分解触媒はオゾン分解触媒(型式EKM-200-004特殊品:岩崎電気(株)を使用した。
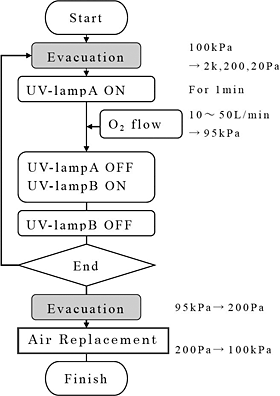
図2 活性酸素種による滅菌処理工程概要
滅菌処理工程の概要を図2に示す。試験インジケータをチャンバー内に配置し密閉,真空ポンプを作動させチャンバー内を所定圧力に到達するまで減圧して停止する(排気工程)。真空ポンプの停止と同時に励起酸素発生用の紫外線ランプ(UV lamp-A)4灯を点灯,ランプ発光の安定のため一定時間(1min)経過後酸素ボンベから流量調節器を介して酸素ガスを一定流量で送り込み,大気圧近傍の所定圧力(通常95kPa)に至るまで酸素を注入する。この間注入された酸素ガスは紫外線により活性種となり滅菌対象物に送り込まれる。酸素注入が停止するとそのまま処理工程に入る(滅菌工程),設定した所定の処理時間が終了すると励起酸素発生用の紫外線ランプは消灯し,代わりにオゾン分解用の紫外線ランプ(UV lamp-B)が点灯してオゾンを一定時間分解処理する(オゾン分解工程)。そして再び排気工程に入り,所定圧力に達した後外気ポートの弁を開き大気を取り込み,大気圧に達したところで処理は終了となる(終了工程)。
2.3 微生物指標による殺菌・滅菌の評価方法
殺菌,滅菌評価用の指標菌として,ガス法(EOG滅菌器など)の滅菌指標として利用される市販のバイオロジカルインジケータ(BI:Biological Indicator)を使用した。製品はSGM Biotech.社の試験紙型BI(Bacillus atrophaeus ATCC♯9372)を用いた。このBIは柵状の担体に10⁶CFU(Colony Forming Unit)の芽胞が担持されグラシン紙の包装袋に封入されている。この包装袋から担体のみを取り出し市販の滅菌袋(ステラッド:J&J製)に入れ替え,更に滅菌袋の同じ面が重ならないように二重に封止して本試験のインジケータとした。使用した滅菌袋は片面が通気性のあるポリエチレン不織布シート(Tyvek®),もう一方の面はポリプロピレン製の透明なフィルムの貼合せでできている。ポリエチレン不織布シートは紫外線を含む光を全く透過せず,ポリプロピレンフィルムは波長310nm以下の紫外線を透過しない5)。滅菌袋を交互に二重にして包装したのは外部から受ける光の影響,気体の流れをインジケータの両側で一定にするためである。従って,異なる材質の面から構成された試験インジケータの中には紫外線ならびに可視光が入らない構成となっている。また,電子顕微鏡(Scanning Electron Microscope:SEM)観察には,同じBacillus属である枯草菌(Bacillus subtilis NBRC 3134)を用いた。なお,試験インジケータとして使用したBacillus atrophaeus ATCC♯9372は旧名Bacillus subtilis ATCC♯9372が学名変更されたものである10)。殺菌(滅菌)効果の評価は,暴露した試験インジケータ中の生残芽胞数を計測することで評価した。暴露後,滅菌袋からBIを取り出し,そのBIから芽胞担持体のみを取り出して10mℓ滅菌水の入ったスピッツ管に入れ,そこに滅菌済グラスビーズを少量加えて激しく攪拌,超音波処理(40kHz)10分間施して滅菌水中に芽胞を溶出させた。そのスピッツ管の上澄み液の一定量を採取し段階希釈した溶液をSCD(Soybean Casein Digest)寒天培地に塗抹して培養した。培養は所定の培養条件(30℃,48hr以上)で評価し,生じた集落の計数を行い残菌数とした。
2.4 銀膜QCM法による酸化能力のモニタリング方法
酸素注入の際のチャンバー内の状況を調べるため2台の水晶微小天秤(Quarts Crystal Microbalance: QCM)を用いて滅菌工程のモニタリングを行った9),10)。QCMセンサヘッド内部には共振周波数6MHzの水晶振動子(SC-101:Inficon製)がそれぞれ内包されており,一方のセンサには銀薄膜(Ag),もう一方のセンサには金(Au)薄膜が対照電極として蒸着されている。銀薄膜付きQCM(Silver-QCM) は,励起酸素の表面作用量を銀(Ag)が酸化され酸化銀(Ag₂O)になる際の質量増加量を周波数変化(⊿f)としてモニタすることで計測する。計測にあたっては,Silver-QCM単独では減圧の影響を受けるので,対照として質量変化のないAuセンサヘッドを用いて差し引き演算で定量する構成をとった。計測は滅菌バック中の試験サンプルと同様にセンサヘッドを滅菌バックの中に入れて計測を行った。
参考文献
- M. Moisan, J.Barbeau, S. Moreau, J. Pettetier, M. Tabrizian and L. H. Yahia: Int. J. Pharm., 226 (2001) 1.
- K. Tamazawa: The Japanese Journal of Medical Instrumentation, 76 (2006) 731.
- N. Hayashi, W. Guan, S. Tsutsui, T. Tomari and Y.Hanada: Jpn. J. Appl. Phys., 45 (2006) 8358.
- M. K. Singh, A. Ogino and M. Nagatsu: New Journal of Physics, 11 (2009) 5027.
- K. Yoshino, H. Matsumoto, T. Iwasaki, S. Kinoshita, K. Noda and S. Iwamori: J. Vac. Soc. Jpn., 54, (2011) 467.
- H. Sugimoto: Application and Foundation of Ozone, (Korin, Tokyo, 1996) p. 20 [in Japanese].
- H. Okabe: Photochemistry of small molecules, (AWiley-Interscience publication, New York, 1978) 1st ed., Vol. 1, Chap. 5, p. 177.
- I. Soumiya: Ozone Handbook, (Sanyuu, Yokohama, 2004) 1st ed. Vol. 1, Chap. 4, p. 53 [in Japanese].
- T. Noguchi: Lighting Handbook, (Ohmsha, Tokyo, 2006) 1st ed. Vol. 1, Chap. 9, p. 508 [in Japanese].
- Fritze D, Pukall R: Int. J. Syst. Evol. Microbiol., 51 (2001) 35.
テクニカルレポートに掲載されている内容は、原稿執筆時点の情報です。ご覧の時点では内容変更や取扱い中止などが行われている可能性があるため、あらかじめご了承ください。
